Luis Antonio Violin Pereira e equipe abordam os conceitos de tecido ósseo imaturo e maduro frente aos processos de microfraturas ósseas e osseointegração.
Previamente1, foram definidas a natureza bioquímica, a organização estrutural cortical ou medular do tecido ósseo e a constituição do tecido mole e do tecido mineralizado do osso. Nesta segunda parte, serão abordados os conceitos de tecido ósseo imaturo e maduro frente aos processos de microfraturas ósseas e osseointegração.
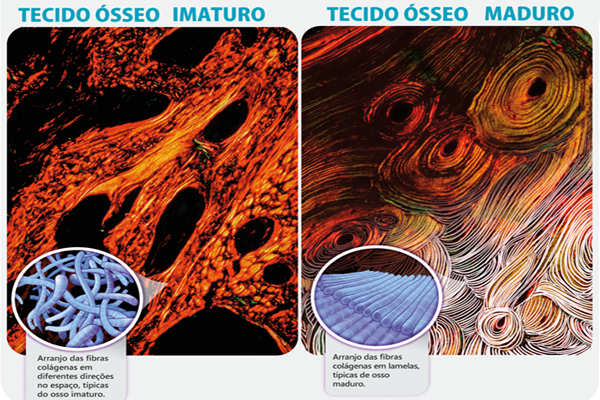
Tecido ósseo imaturo, primário ou não lamelar
Embriologicamente, é o tecido ósseo inicial que forma o esqueleto de um embrião em desenvolvimento. Em adultos, o osso imaturo é encontrado originalmente nos alvéolos dentários (em constante processo de remodelação óssea) e em áreas de remodelação óssea; ou ainda nos estágios iniciais da regeneração óssea de uma fratura2. O osso imaturo também é encontrado nos estágios iniciais do processo de osseointegração. As características básicas do tecido ósseo imaturo são:
• Índice de formação óssea de 60 μm/dia;
• Ausência de organização lamelar, devido ao arranjo desordenado das fibras colágenas;
• Grau reduzido de mineralização da matriz óssea;
• Número elevado de células por unidade de área;
• Disposição aleatória das células no tecido;
• Se comparado ao tecido ósseo maduro, ocorre maior afinidade pelo corante hematoxilina, devido à grande quantidade de substância fundamental na matriz óssea.
• O tecido ósseo imaturo se forma primeiro e mais rapidamente que o tecido ósseo maduro.
Tecido ósseo maduro, secundário ou lamelar
É o tecido ósseo predominante em adultos2, e suas características básicas são:
• Índice de formação óssea de 10 μm/dia;
• Presença de organização lamelar, devido ao arranjo bem orientado das fibras colágenas. Entende-se como organização lamelar quando os feixes de colágeno estão mineralizados e orientados paralelamente ou circunferencialmente entre si – e não de forma aleatória – para melhor dissipar forças mecânicas e resistir a estímulos que poderiam provocar microfraturas;
• Grau elevado de mineralização da matriz óssea;
• Baixo número de células por unidade de área;
• Disposição longitudinal das células nas lamelas;
• Maior afinidade pelo corante eosina, devido à pequena quantidade de sustância fundamental na matriz óssea.
Transição do tecido ósseo imaturo para o tecido ósseo maduro
O ponto mais importante é que o tecido ósseo imaturo não “amadurece”. Em condições fisiológicas normais, ele é reabsorvido e substituído por tecido ósseo maduro no primeiro ciclo de remodelação. Tanto o tecido ósseo imaturo (depositado por ossificação intramembranosa) quanto o tecido ósseo maduro (depositado por ossificação endocondral) são substituídos durante o processo de remodelação, e a estrutura final formada é idêntica em ambas as situações3.
A remodelação óssea é constante ao longo da vida, e os objetivos desse processo são regenerar microfraturas espontâneas (para conservar a estrutura esqueletal e estabelecer um ponto ideal de resistência óssea) e manter a homeostase de cálcio4. O estabelecimento de um ponto ideal de resistência óssea tem relação direta com o grau de organização das lamelas ósseas5. Este ponto ideal é determinado por meio de: 1) microfraturas geradas por forças capazes de danificar canalículos que interligam prolongamentos de osteócitos, levando à morte celular; 2) reabsorção desse tecido ósseo necrótico pelos osteoclastos e liberação de fatores de crescimento do osso fraturado; e 3) formação de novo tecido ósseo pelo osteoblasto.
Em condições fisiológicas, a quantidade de osso reabsorvido é substituída pela mesma quantidade de osso neoformado, que tende a ter lamelas ósseas mais organizadas espacialmente (mais maduras), ou seja, mais resistentes a estímulos que poderiam provocar novas microfraturas. Portanto, até certo ponto, segundo a lei de Wolff, estímulos mecânicos intensos e frequentes (entre 2.500 e 4.000 unidades de microtensão) reforçam o tecido ósseo durante o processo de remodelação, por aumento da massa óssea e, possivelmente, por levá-lo a um grau mais avançado de amadurecimento (organização lamelar) da matriz óssea.
Uma vez instalado o implante de titânio no tecido ósseo, forma-se um coágulo (fibrina) ao redor do implante e, externamente a essa estrutura, encontra-se uma camada de aproximadamente 1 mm de espessura de tecido ósseo necrótico. Nos dias subsequentes, o tecido ósseo necrótico começa a ser reabsorvido pelos osteoclastos oriundos da área de osso vivo6. Entre a primeira e a segunda semana após a instalação do implante, a reabsorção óssea estimula os osteoblastos a iniciarem o processo de neoformação de osso imaturo. Em geral, entre oito e 12 semanas (a depender do tratamento de superfície do implante e do protocolo de carregamento), o osso imaturo começa a ser remodelado e substituído pelo maduro. Assim, a remodelação óssea se mantém indefinidamente ativa, uma vez que é estimulada pela função oclusal7.
REFERÊNCIAS
1. Pereira LAVD, Consonni SR, Costa CFP. Histologia óssea para perioimplantodontistas – parte 1. ImplantNewsPerio 2019;4(3):642-4.
2. Pawlina W. Ross Histologia texto e atlas – correlações com Biologia celular e molecular (7ª ed.). Guanabara Koogan, 2016.
3. Yamada AT, Joazeiro PP, Pereira LAV, Consonni SR. Biologia tecidual: um guia ao microscópio [On-line]. Disponível em . Acesso em: 30-7-2019.
4. Kierszenbaum AL, Tres LL. Histologia e Biologia Celular – uma introdução à Patologia (4ª ed.). Rio de Janeiro: Elsevier, 2016.
5. Carvalho HF, Collares-Buzato CB. Células – uma abordagem multidisciplinar (1ª ed.). Barueri: Manole, 2005.
6. Pereira LAVD, Elias CN, Costa CFP. Como a superfície do implante de titânio interage com o tecido ósseo? ImplantNewsPerio 2018;3(5):831-3.
7. Davies JE. Understanding peri-implant endosseous healing. J Dent Educ 2003;67(8):932-49.
SUGESTÕES DE LEITURA
• Monje A, Aranda L, Diaz KT, Alarcon MA, Bagramian RA, Wang HL et al. Impact of maintenance therapy for the prevention of peri-implant diseases: a systematic review and meta-analysis. J Dent Res 2016;95(4):372-9.
• Insua A, Monje A, Wang HL, Miron RJ. Basis of bone metabolism around dental implants during osseointegration and peri-implant bone loss. J Biomed Mater Res A 2017;105(7):2075-89.
• Meirelles L, Brånemark PI, Albrektsson T, Feng C, Johansson C. Histological evaluation of bone formation adjacent to dental implants with a novel apical chamber design: preliminary data in the rabbit model. Clin Implant Dent Relat Res 2015;17(3):453-60.
• Misch CE, Wang HL, Misch CM, Sharawy M, Lemons J, Judy KW. Rationale for the application of immediate load in implant dentistry: part I. Implant Dent 2004;13(3):207-17.
Luis Antonio Violin Pereira
Professor titular do Depto. de Bioquímica e Biologia Tecidual da Universidade Estadual de Campinas – Instituto de Biologia (Unicamp-IB).
Orcid: 0000-0002-9332-7285.
Colaboração:
Carolina Frandsen Pereira da Costa
Ilustradora; Doutoranda no programa de pós-graduação em Biologia Celular e Estrutural do Instituto de Biologia (Unicamp-IB).
Orcid: 0000-0001-8009-0517.
Sílvio Roberto Consonni
Professor doutor do Depto. de Bioquímica e Biologia Tecidual da Universidade Estadual de Campinas – Instituto de Biologia (Unicamp-IB).
Orcid: 0000-0003-3149-021X.